Partie 1 - La chimie du chlore sans stabilisant
A. Que devient le chlore sans stabilisant
Sans stabilisant dans l'eau, le chlore dans une piscine prend deux formes :
Et l'ion hypochlorite OCl- 
(La boule verte représente l'atome de chlore  )
)
Quand vous mesurez le taux de chlore (libre) avec vos bandelettes ou vos kits piscine, vous mesurez en réalité les ions hypochlorites et l'acide hypochloreux présents dans votre piscine :

L'acide hypochloreux (HOCl) est la forme du chlore la plus bactéricide, oxydante. C'est uniquement lui qui assure la désinfection et l'oxydation des composés organiques de votre piscine.
La proportion acide hypochloreux / ion hypochlorite dépend du pH selon la relation suivante :
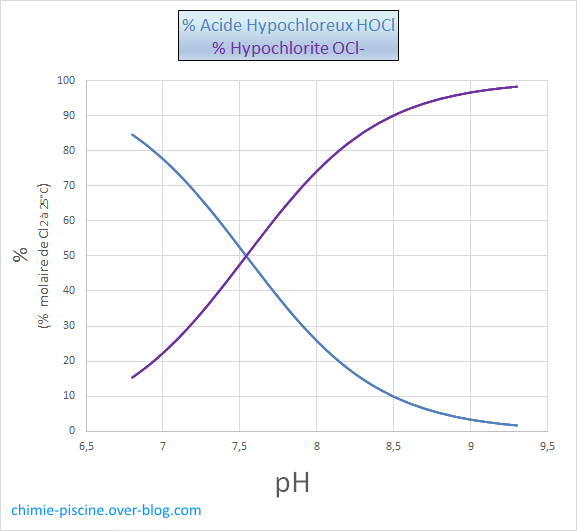
Graphe n°1 : % molaire HOCL/OCL- en fonction du pH
Observation : La proportion d'acide hypochloreux augmente quand le pH diminue :
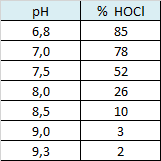
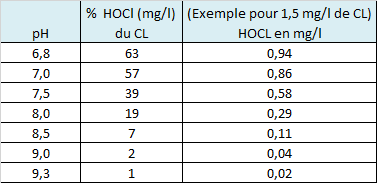
Attention ! Le graphe n°1 (et le tableau n°1) représente une proportion en nombre de molécules (% molaire).
La chimie c'est parfois compliquée mais voici un graphe qui vous donnera une idée du % en masse de l'acide hypochloreux par rapport au chlore libre :
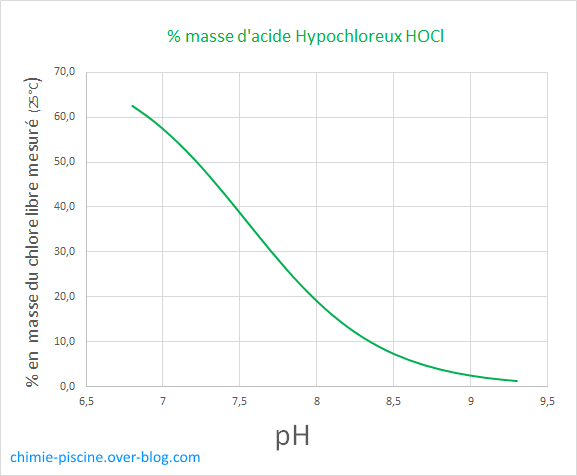
C'est très similaire au 1er graphe à quelques pourcentages près.
----------------------------------------------------------------------------------------------------------------
(*) A pH 7.0 l'acide hypochloreux représente 78% du chlore libre (CL) que vous mesurez avec vos kits d'analyse (bandelettes, kits avec pastille DPD n°1). N'en déduisez pas que si vous mesurez 2 mg/l de chlore libre vous avez (2 x 0.78 = ) 1.56 mg/l d'acide hypochloreux dans votre eau.
Cette déduction est fausse car 2 mg/l représentent en réalité 1.15 mg/l d'acide hypochloreux.
L'unité de mesure du chlore libre est exprimée en mg/l de Cl2 (la forme gazeuse du chlore) et la masse de la molécule d'acide hypochloreux représente 74% de la masse du chlore gazeux (2 x 0.78 x 0.74 = 1.15)
-----------------------------------------------------------------------------------------------------------------